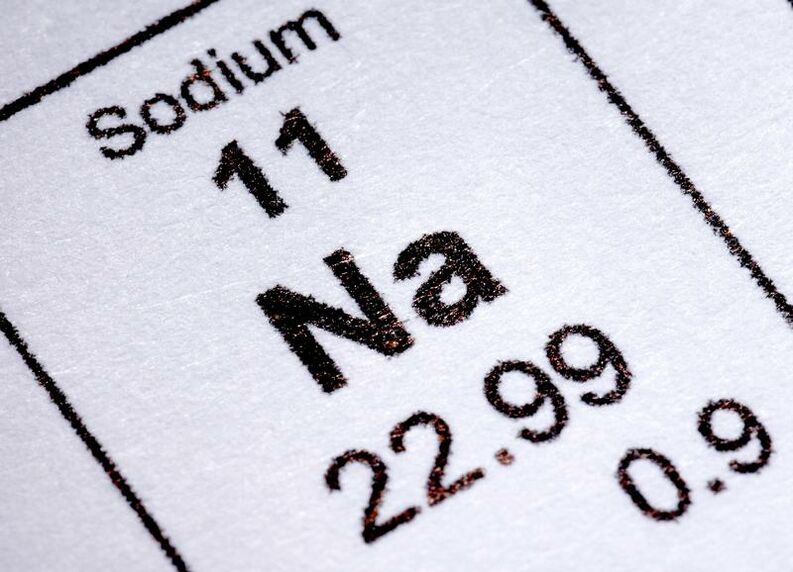
Sodio (Metales alcalinos)
Número Atómico: 11
Grupo: 1
Periodo: 3
Configuración Electrónica: [Ne] 3s1
Estados de oxidación: +1
Electronegatividad: 0.93
Radio atómico / pm: 185.8
Masa atómica relativa: 22.989 769 28 (2)
Tabla de Contenidos
Energía de ionización
Primera energía de ionización / kJ mol-1: 495.85
Segunda energía de ionización / kJ mol-1: 4562.48
Tercera energía de ionización / kJ mol-1: 6910.33
Propiedades Físicas
Densidad / g dm-3: 971 (293 K)
Volumen molar / cm3 mol-1: 23.68 (293 K)
Resistencia eléctrica / µΩcm: 4.2 (20 °C)
Abundancia del elemento
La atmósfera / ppm: –
La corteza terrestre / ppm: 23000
Los océanos / ppm: 10600
Propiedades térmicas
Conductividad térmica / W m-1K-1: 141
Punto de fusión / °C: 97.72
Punto de ebullición / °C: 883
Calor de fusión / kJ mol-1: 2.64
Calor de vaporización / kJ mol-1: 99.2
Calor de atomización / kJ mol-1: 107.566
Isótopos
Isótopo: 23Na
Masa atómica relativa: 22.9897697(2)
Porcentaje por masa (%): 100
Datos cristalográficos
Estructura cristalina: cúbica centrada en el cuerpo
Dimensiones de la celda unidad / pm: a=429.06
Grupo espacial: Im3m
Historia y descubrimiento del Sodio:
El honor de haber descubierto el Sodio se lo reserva el químico británico Sir Humphry Davy quien logró aislarlo en el año 1807 a través de un proceso de electrólisis aplicado a la sosa cáustica, la cual le daría origen a su nombre, que viene a su vez del italiano soda que se traduce como «sosa». En la antigüedad y sobre todo en la Europa Medieval este elemento era empleado por muchos médicos de la época como un remedio contra la migraña en un compuesto llamado sodanum.
No fue hasta el año 1814 cuando el químico Jöns Jacob en su Sistema de Símbolos Químicos utilizó por primera vez la nomenclatura Na para denominar este elemento químico, Su uso estuvo derivado de la palabra latina natrium que a su vez estaba derivada de la palabra egipcia natrón que era el nombre utilizado por esta civilización para denominar el carbonato de sodio.
Principales características:
El Sodio presenta características semejantes a otros metales alcalinos, siendo un metal blando, de color plateado y ligero que no se encuentra de manera libre en la naturaleza, este se encuentra principalmente en lo océanos de nuestro planeta en forma iónica. se puede encontrar en otros muchos minerales entre los que podemos destacar la halita y la zeolita, el sodio está considerado como un mineral esencial para la vida en la tierra.
Su nomenclatura científica es Na, su número atómico es 11 y su peso atómico es 22 989 g/mol. Tiene como punto de ebullición los 880 ºC. Su densidad a temperatura ambiente es 0.968 g/cm3 y en estado líquido (punto de fusión): 0,927 g/cm3.
La corteza terrestre contiene aproximadamente un 2.6% de sodio, lo que lo hace el metal alcalino más abundante y el sexto de todos los elementos de la tabla periódica. Además, se puede encontrar presencia del mismo de manera abundante en las estrellas detectandose a través de las líneas espectrales.
En las condiciones adecuadas reacciona con el agua de manera espontánea.
Funciones biológicas del Sodio:
Varios de los procesos biológicos y fisiológicos fundamentales para el organismo humano, tienen al Sodio uno de sus elementos con presencia fundamental en mucho de ellos. Por esta razón es importante destacar el papel fundamental que juega el catión de sodio (Na+) en el metabolismo celular, asimismo su rol principal en el correcto balance de la osmolaridad.
Además, tiene a su cargo el mantenimiento del potencial de membrana, al expulsarse en intercambio con el segundo electrolito en importancia, el potasio, necesario para la transmisión del impulso nervioso y para la excitabilidad normal de los músculos del cuerpo humano.
Como función fundamental a destacar del Sodio está su presencia en los cristales minerales de la matriz ósea.
Finalmente, es el encargado de mantener el balance o equilibrio ácido-base de nuestro metabolismo, así como regular la presión arterial y el volumen sanguíneo.
Principales usos del Sodio:
Los diferentes compuestos de Sodio son altamente demandados en la industria manufacturera como en la industria química, entre sus principales aplicaciones podemos destacar las siguientes:
Carbonato y bicarbonato
En primer lugar su uso fundamental está vinculado a la fabricación de limpiadores, detergentes y vidrios para ventanas. Igualmente, se emplea como componentes de los desarrolladores en el mundo de la fotografía.
Hidróxido
El uso principal de la sosa cáustica o lejía está dado por su papel en la neutralización de ácidos en el refinamiento del petróleo. Además de reaccionar con ácidos grasos para la fabricación de jabones en la industria del aseo. En cambio otro uso importante es el que se le da para el tratamiento de la celulosa.
Sulfato
Se utiliza en la fabricación del papel kraft, cartón, vidrio y detergentes. El tiosulfato de sodio es utilizado en la fotografía con el fin de corregir los negativos y las impresiones desarrolladas.
Cloruro
Es usado para sazonar y conservar los alimentos. La electrólisis del cloruro de sodio produce hipoclorito de sodio (NaOCl), utilizado en la limpieza del hogar como cloro. Ya que es un excelente blanqueador, se usa de manera abundante en la industrial de la pulpa del papel y los textiles o en la desinfección del agua.
Por su parte, en algunas preparaciones medicinales el hipoclorito es utilizado como antiséptico y fungicida.
Precauciones y riesgos para la salud:
Debido a que el Sodio en su forma metálica es sumamente explosivo en agua al igual que con otros elementos, el mismo debe ser manipulado cuidadosamente, preferiblemente por personal especializado, además debe almacenarse en una atmósfera inerte, por ello es que se almacena en parafinas o gases nobles, evitando por todos los medios su contacto con el agua, ya que esto podría causar graves daños.
Su contacto con tejidos humanos recubiertos con agua puede causar daños severos y quemaduras graves, por lo tanto se recomienda trabajar con precaución y con los medios de protección adecuado para evitar daños por reacciones químicas inesperadas cuando estemos trabajando con dicho elemento.
La ingesta excesiva de sodio en comidas y bebidas que consumimos a diario puede traer consigo un incremento en la concentración plasmática y sanguínea de los individuos, pudiendo ser esta la causa de enfermedades como la hipertensión arterial, enfermedades cardiovasculares y accidentes cerebrales. Por ello la Organización Mundial de la Salud recomienda no consumir más de 2000 mg al día ya que con ello evitamos las enfermedades derivadas de este tipo de padecimientos.
Deja una respuesta