Tabla de Contenidos
Propiedades físicas
Densidad / g dm-3: 862 (293 K)
Volumen molar / cm3mol-1: 45.36 (293 K)
Resistencia eléctrica / µΩcm: 6.15 (20 °C)
Metales alcalinos
Número atómico: 19
Configuración electrónica: [Ar] 4s1
Masa atómica relativa: 39.0983(1)
Grupo: 1
Electronegatividad: 0.82
Radio atómico / pm: 227.2
Periodo: 4
Estados de oxidación: +1
Energía de ionización
Primera energía de ionización/ kJ mol-1: 418.81
Segunda energía de ionización/ kJ mol-1: 3051.85
Tercera energía de ionización/ kJ mol-1: 4419.64
Propiedades térmicas
Calor de fusión / kJ mol-1: 2.4
Conductividad térmica / W m-1K-1: 102
Calor de atomización / kJ mol-1: 90.14
Punto de ebullición / °C: 759
Calor de vaporización / kJ mol-1: 79.1
Punto de fusión / °C: 63.28
Datos cristalográficos
Grupo espacial: Im3m
Longitudes de la celda unidad/pm: a=533.4
Estructura cristalina: cúbica centrada en el cuerpo
Abundancia de elemento
Corteza terrestre / ppm: 9100
Atmósfera / ppm: —
Océanos / ppm: 380
Isótopos
| Isótopo | Masa atómica relativa | Porcentaje por masa (%) |
| 39K | 38.9637068(3) | 93.2581(44) |
| 40K | 39.9639987(3) | 0.0117(1) |
| 41K | 40.9618260(3) | 6.7302(44) |
Potenciales estándar de reducción
| Semirreacción | Be2+ + 2e→ Be(s) | 1.85 |
| Eo / V | Be2O32- + 3H2O + 4e- → 2Be(s) + 6OH- | – 2.62 |
El potasio es un metal que se localiza en la sangre. El cuerpo lo adquiere a partir de la ingestión de alimentos entre los que destacan las frutas y las verduras. Es el potasio el tercer mineral más abundante en todo el metabolismo. Entre sus funciones más destacadas se encuentran la de mejorar considerablemente la relación existente entre los nervios de los músculos, la circulación de los nutrientes de las células y expulsar los desechos de éstas. El organismo necesita de este mineral para casi todo su funcionamiento, incluso para la funcionalidad del riñón y del corazón, la contracción muscular y la transmisión nerviosa.
Propiedades del potasio
El potasio es un elemento de la tabla periódica cuyo símbolo químico es K (del latín científico potassium, y este del alemán pottasche, ceniza de pote). Su número atómico es 19. Como elemento químico se puede encontrar en la naturaleza cerca del agua salada y otros minerales. Al ser un metal alcalino posee un color blanco-plateado. El potasio se oxida prontamente en el aire, es demasiado reactivo, sobre todo en el agua, y se parece químicamente al sodio. Este elemento debe ser protegido del aire para prevenir la corrosión del metal por el óxido e hidróxido. Algunas veces, las muestras son conservadas bajo un medio reductor como el queroseno. Con el litio o sodio con agua, la reacción puede llegar a ser más violenta, y es suficiente exotérmica para que el gas hidrógeno perfeccionado se prenda.
A veces el potasio es usado solo, pues como reacciona rápidamente con solo unos indicios del agua, y sus valores de reacción son indisolubles, o como NaK (es esta una combinación con el sodio que es líquida a temperatura ambiente) que se utilizan antes de la destilación para secar solventes. En este caso, el elemento denominado K sirve como un poderoso disecante. El hidróxido de potasio reacciona potentemente con el dióxido de carbono, por la elevada energía del ion K+. Este ion es incoloro en el agua. Los métodos que se utilizan para la separación del potasio incluyen precipitación y algunas veces por el análisis gravimétrico.
Aplicaciones del potasio
Uno de los usos más frecuentes que se da al potasio metal es en las células fotoeléctricas. Ya en el caso del cloruro y el nitrato se puede utilizar como fertilizante para cultivos.
Bomberos y mineros utilizan el potasio para proteger sus vías respiratorias, sin embargo, este también puede ser usado para la elaboración de pólvora o jabón. En el caso de las actividades pirotécnicas se emplea el cromato y el dicromato.
Frecuentemente las grandes industrias utilizan potasio para la elaboración de cristales y para la transferencia de calor usan la aleación NaK (sodio y potasio).
En el caso de las inyecciones con carácter letal resulta de utilidad el cloruro de potasio.
El cloruro de potasio se utiliza para provocar un paro cardíaco en las ejecuciones con inyección letal.
Entre los alimentos que destacan por ser ricos en potasio están las hortalizas. Dígase: brócoli, remolacha, berenjena y coliflor) judías y las frutas (los bananos y las de hueso, como aguacate, albaricoque, melocotón, cereza y ciruela.
Influencia del Potasio en la salud
El potasio puede ser encontrado en diferentes alimentos como son: vegetales, frutas, patatas, carne, pan, leche y frutos secos. Por otra parte, el potasio desempeña importantes funciones dentro del cuerpo humano, ya sea en lo relacionado con el sistema de fluidos, así como con las funciones de los nervios. En muchas ocasiones se atribuye el mal funcionamiento de los riñones a la acumulación de potasio, lo que también puede originar problemas en el ritmo cardíaco.
¿Puede el potasio ser nocivo?
Los investigadores se siguen preguntando si el potasio puede causar daños en las personas que tienen una función renal normal (pues el exceso de esta sustancia se elimina mediante la orina), pero por desgracia aún no tienen una respuesta para esta pregunta.
En el caso de las personas que tienen enfermedades renales crónicas el uso de algunos medicamentos con altas concentraciones de potasio puede causar grandes afectaciones. En este caso se encuentran los diuréticos y los inhibidores de la enzima convertidora de la angiotensina. Para las personas que consumen estos medicamentos las complicaciones pueden surgir con facilidad, aunque su dieta no incluya grandes cantidades de potasio.
Aquellas personas que padecen de diabetes tipo 1 pueden sufrir de hipercalemia además de enfermedades hepáticas, cardíacas e insuficiencia renal.
Para las personas que no sufren ningún tipo de padecimiento médico el alto consumo de potasio, o sustitutos de la sal, también existe peligro pues el organismo no es capaz de eliminar el exceso.
Efectos ambientales del Potasio
Uno de los datos más relevantes a cerca del potasio tiene que ver con que es esencial para la supervivencia de la flora (algo que también ocurre en el caso del nitrógeno y el fósforo). El suelo necesita de este elemento químico no solo por lo explicado anteriormente referido a la flora, sino que también los animales se nutren de este.
Tal es su importancia que la demanda de potasio resulta verdaderamente elevada. Su principal propósito es el mantenimiento de la presión osmótica y el tamaño celular. Por ello también influyen notablemente en los procesos de fotosíntesis y producción energética (también tiene que ver con la apertura de los estomas, la carnosidad de las plantas y los aportes de dióxido de carbono).
Cuando los organismos poseen bajas cantidades de potasio esto se manifiesta a través de diversos síntomas como son la restricción del crecimiento, la poca abundancia de las cosechas y mala calidad en la producción. Pero los elevados niveles de potasio soluble en el agua tampoco son buenos debido a que pueden originar daños a las semillas en germen ya que inhiben otros minerales y reducen la calidad de estos cultivos.
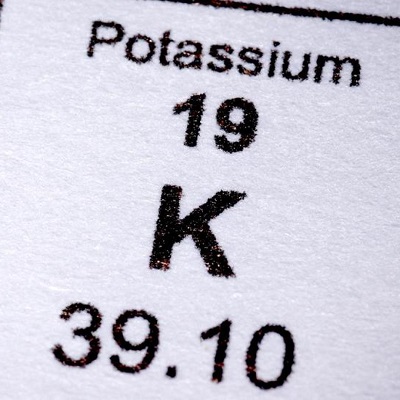
Deja una respuesta