En la tabla periódica, exactamente en la columna 18 se encuentran los gases nobles; llamados así porque sus propiedades son muy similares, esto quiere decir que son: Inodoro, incoloro, y no reaccionan entre si. En esta columna se encuentran: El Helio (He), el Neón (Ne), el Argón (Ar), el Kriptón (kr), el Xenón (Xe), y el Radón (Rn); pero ¿qué los hace especiales? Y es que en condiciones normales, presentan poca reactividad química; es por ello que se entiende que no reaccionan ante otros elementos.
En el antes conocido como el grupo cero (0), se nota que 4 de los 7 elementos de esta columna, se obtienen del aire; mediante la licuefacción (que es hacer que el gas pase a ser líquido) y la destilación fraccionada (separación del líquido de una mezcla por el calor); y uno de ellos es el Neón, de la cual hablaremos ahora.
Tabla de Contenidos
El Neón un gas noble
El neón es un elemento químico representado en la tabla periódica como Ne, muy abundante en el universo; es incoloro porque no tiene color alguno; e inodoro porque no posee olor, y en su forma normal se puede encontrar en estado gaseoso; se le conoce también como un gas monoatómico, y esto quiere decir que sus átomos no están unidos entre si.
Descripción
- Nro. Atómico: 10.
- Peso atómico:. 20, 180 u.
- P. De ebullición: -246 grados centígrados o en grados kelvin de 27,10.
- P. De fusión: -248,6 grados centígrados o grados kelvin de 24, 56.
- Densidad: 1,20 g/ml.
- Radio Van der Waals: 154 pm.
- Radio atómico: 38 pm.
- Masa atómica: 20,1797 u.
- Radio convalente: 69 pm.
¿Cómo fue descubierto?
 Un innovador y profesor de química, nacido en Glasgow, el 2 de octubre de 1852; era Sir. Willians Ranzay quien dio un importante aporte a la humanidad. Que después de jubilarse de profesor, se dedicó a trabajar con la química orgánica; pero fue en la inorgánica donde hizo importantes descubrimientos.
Un innovador y profesor de química, nacido en Glasgow, el 2 de octubre de 1852; era Sir. Willians Ranzay quien dio un importante aporte a la humanidad. Que después de jubilarse de profesor, se dedicó a trabajar con la química orgánica; pero fue en la inorgánica donde hizo importantes descubrimientos.
Pues, realizando un trabajo sobre el óxido de nitrógeno, descubrió que este elemento era más pesado atómicamente en la atmósfera; dando esta investigación, el paso al descubrimiento del argón (Ar).
Continuó realizando investigaciones, según las bases que Mendeleiev había dejado con la tabla periódica; y de manera cuidadosa decidió, descubrir cuales eran los gases inertes que faltaban en la tabla; hallando así el neón (en 1898), el Kriptón, el xenón y por último el helio.
A este grupo de gases descubiertos, se les llamó gases nobles; y nadie antes del grupo de Ransay los había encontrado, su importante aporte cambió toda la manera de ver a la tabla periódica y la forma de aplicación de cada elemento.
Porque con este descubrimiento, también se supo que los gases nobles serían de gran utilidad; y es por esta razón que William Ransay, se le otorgó el premio novel de química; y hasta ahora es conocido como el mayor descubridor químico. Falleciendo así el 23 de julio de 1916. Sus aportes a la química, son de gran ayuda para las investigaciones actuales.
Características del Neón (Ne)
Como un gas noble, este elemento en conjunto a los otros que lo conforman; tiene características similares; pero el neón en particular, tiene rasgos distintivos a los demás gases como:
2do gas más ligero
Es el segundo gas noble más ligero después del helio (He), por tener 3 isotopos estables (que no son radioactivos), que lo hace estable en su forma natural.
Poder de refrigeración
Pues su poder de refrigeración es superior al helio líquido por 40 veces y tres veces más que el hidrógeno; llegando a ser este último reemplazado por el neón.
Incoloro e inodoro
Con estas dos características, se puede decir que el neón es transparente; pues no tiene olor ni color alguno en su estado natural.
Hidrato
El neón puede formar un hidrato inestable, lo que quiere decir que contiene partículas de aguar; y puede que no sea tan inerte como se cree.
Más abundante
El neón es uno de los 5 elementos más abundante en el universo; en conjunto al carbono, el oxígeno, el helio y el hidrógeno.
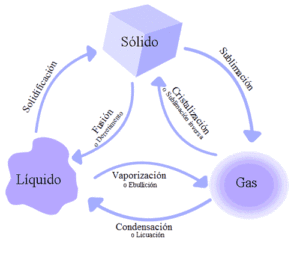
 Punto triple
Punto triple
Explica que este elemento de la tabla periódica, puede estar en equilibrio en el estado: líquido, solido y gaseoso.
Y se evapora con rapidez.
Aplicaciones
- Se utiliza para señalizaciones de publicidad (anuncios, letreros, carteles, entre otros).

- Para luces que indiquen alto voltaje.
- Es utilizado en investigaciones de alta energía.
- En tubos de televisión (aunque en la actualidad ha sido reemplazada).
- Al unirse con el helio, se crea un tipo de láser.
- Licuado sirve como refrigerante criogénico (produce bajas temperaturas previniendo o evitando cualquier flujo de calor).
- En su estado líquido es muy usado para la refrigeración.
- Tubos de vacío (usado para amplificar señales).
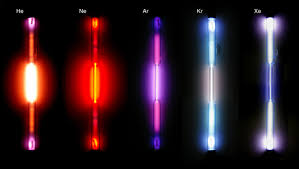
- Lámparas de neón, estos pueden venir con el característico color naranja o rojizo que se produce cuando el neón se coloca en el tubo; pero al mezclarse con ciertos gases (como: Helio, dióxido de carbono, y mercurio), pueden surgir diferentes colores.

- Pararrayos para proteger los equipos electrónicos.
- Tubos de onda de medición (mide las ondas de rayos de luz).
Modo de obtención
A pesar de ser muy abundante en el universo, el neón es un gas monoatómico (se constituye de un solo átomo); y no se encuentra muy abundantes en la corteza terrestre, se consiguen en las trazas de aire.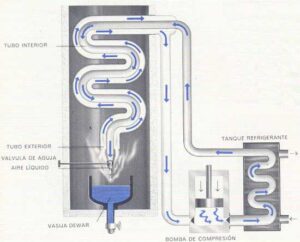
Entonces, para poder obtener el neón; el aire debe pasar por un proceso de licuefacción, que es el proceso que hace pasar el gas a un estado líquido (por medio de los cambios de temperatura y la presión); y la destilación fraccionada, que es la manera química de separar una mezcla de homogénea de líquidos por medio del calor; este proceso se hace porque el neón viene acompañado con un poco de nitrógeno y helio.
Efectos sobre:
Por ser un gas se debe estudiar los efectos que causa a los seres vivientes y a la ecología.
Salud
El neón se puede contener, y si uno de esos contenedores es expuesto se puede inhalar; como el neón se evapora, fácilmente; provocaría una sobresaturación en el aire, corriendo peligro todos los que estén alrededor por asfixia; si se está en sitios cerrados.
Síntomas

- Asfixia.
- Congelación en la piel y en los ojos, al contacto con este elemento en estado líquido.
- Mareos.
- Nauseas.
- Vómitos.
- Perdida de la conciencia.
- Convulsiones.
- Y hasta la muerte.
Todo en cuestión de segundos.
Ambiente
Por ser un gas inerte no causa ningún daño ecológico.
El neón gas noble
Este elemento químico descubierto por Willians Ransay en 1898, permitió ver de manera diferente a la tabla periódica; porque con este gran descubrimiento inventar muchas cosas, que son de gran utilidad en la actualidad.
Es impresionante que de un trazo de aire, se pueda obtener algo tan estable como la luz de neón; y también encontrarse con el segundo gas más ligero de la tabla periódica.
Tal vez quieras saber sobre: Germanio


 Punto triple
Punto triple
Deja una respuesta