Los lantánidos son comúnmente llamados tierras raras. Se encuentran integrados por: Praseodimio (Pr), Lutecio (Lu), Iterbio (Yb), Tulio (Tm), Erbio (Er), Holmio (Ho), Disprosio (Dy), Terbio (Tb), Gadolinio (Gd), Europio (Eu), Samario (Sm), Prometio (Pm), Neodimio (Nd) y Cerio (Ce).
La semejanza de sus propiedades al lantano acota su nombre como lantánidos.
A pesar de ser llamados tierras-raras, estos elementos no escasean en la naturaleza. Se estima que en la corteza terrestre hay mayor reserva de lantánidos que de plata.
Los lantánidos son fruto del súbito refrescamiento de las rocas derretidas y otros procesos, produciéndose minerales con más de la mitad de su composición ocupada por tierras raras. En la Luna también hay gran cantidad de lantánidos siendo esto de gran relevancia para el estudio de ese satélite.
La presencia de estos elementos en los meteoritos se asocia a teorías sobre el origen del universo y la aparición de los elementos químicos.
Tabla de Contenidos
Estructura atómica
Debido a su estructura, todos los lantánidos tienen propiedades semejantes. Son elementos trivalentes ya que poseen tres electrones en los niveles más alejados de los átomos que participan en sus enlaces de valencia. El Praseodimio, el Cerio y el Terbio existen también en estado monovalente. El Iterbio, el Samario y el Europio crean compuestos divalentes, sencillamente oxidables.
Descubrimiento y Obtención
Los primeros lantánidos fueron descubiertos en 1794 por Johan Gadolin, cuando indagaba sobre el mineral Iterbita, encontrado en 1788 en Suecia. Luego Jöns Jacob Berzelius al investigar la cerita, supuso haber descubierto lo que sería la tierra de cerita.
Del 1839-1843, Carl Gustav, Monsander logró disgregar tanto la tierra Itria y por separación procuró origen a los óxidos de Erbio, Terbio y del propio Itrio.
El francés Paul-Émile Lecoq de Boisdran en 1789 separó por precipitación el Samario del Didimio. En 1880, un sueco llamado Per Teodor Cleve desdobla el óxido de erbio en los óxidos de holmio, tulio y de erbio.
Posteriormente en 1885, Karl Auer, apartó, los óxidos de praseodimio y de neodimio del didimio, basándose en técnicas de diferencias de solubilidad y basicidad.
Posteriormente se fueron descubriendo el resto de los lantánidos. La historia de las tierras raras está trazada por el conflicto de separación de los diversos elementos a través de procesos químicos. Incluso al estar presentes en proporciones abundantes, los métodos de espectroscopía, son los que proveen un medio eficaz para la determinación de la abundancia relativa de cada uno de estos elementos.
Generalidades de los Lantánidos:
Los lantánidos son los 14 elementos que siguen al lantano en la tabla periódica, donde los catorce electrones 4f se incrementan sucesivamente a la disposición del lantano.
El radio de los lantánidos va decreciendo según se va incrementando su número atómico. Estos cambios no son notables, pero se acumulan.
Diversas cualidades del comportamiento espectral y magnético de los lantánidos son diferentes a los del propio bloque de los elementos de transición. Debido a esto los estados que se originan desde las variadas configuraciones 4fn sólo son levemente afectados por el contorno que rodea a los iones. Entonces permanecen usualmente inmutables para un explícito ion en todos sus compuestos. Lo cual es conocido como contracción de los lantánidos.
Es destacable la fluorescencia o luminiscencia de ciertos iones lantánidos, principalmente los de europio, al usarlos como activadores en las redes cristalinas de los silicatos, óxidos de los metales de transición u óxidos lantánidos.
Estado natural y separación:
La abundancia de los lantánidos es bastante alta, y se conocen como tierras raras ya que se encuentran en las mezclas de óxidos. El más escaso es el Tulio y es más común que el mercurio y el selenio.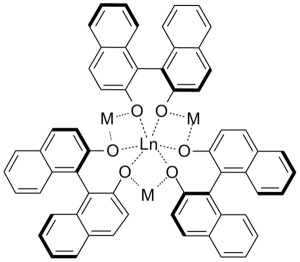
Los lantánidos son separados de los otros elementos por precipitación de fluode oxalatos. Los elementos son separados entre sí mediante el intercambio de iones, y con fines de comercio se realiza en gran escala.
Su comportamiento durante el intercambio de iones es inducido principalmente por el radio iónico hidratado. Los nitratos trivalentes de lantánidos también se pueden ser extraídos en condiciones apropiadas. Esta facilidad de extracción en algunas condiciones se aumenta con el incremento del número atómico; siendo mayor en ácidos fuertes o en elevadas concentraciones de nitratos.
Características y usos de los Lantánidos:
El praseodimio es un metal amarillento que es soluble en ácidos diluidos. Su óxido se emplea en la fabricación de arcos de incandescencia de carbón, muy útiles en proyectores y focos. Sus sales son empleadas en la elaboración de piedras para encendedores, y como colorantes de esmaltes y vidrios.
El neodimio se utiliza en la investigación metalúrgica, en la producción de vidrios coloreados para lentes astronómicas y en la confección de láseres.
El promedio es de color blanco argénteo y se considera un metal radioactivo. Es empleado en generadores nucleares, como fuente de rayos X y como contador de espesor.
El samario es un metal quebradizo pero duro. Su dureza es similar a la del hierro y posee una gran capacidad de absorción de neutrones. Se obtiene a partir de la reducción del óxido con bario y lantano. Y es empleado en la fabricación de magnetos permanentes, como absorbente de neutrones y como edificador de cristales láser.
El europio es un metal de color gris acerado, maleable y blando, que se oxida rápidamente en el aire y es el más reactivo de los lantánidos. Y es empleado como activador del itrio al poner el color rojo en las pantallas de TV. También como atractivo de neutrones en control nuclear; y como gomas de sellos de correos para permitir su identificación electrónica. Así como agente contaminador de láseres plásticos.
El holmio es muy utilizado en espectroscopia, electroquímica e investigación.
El erbio es de baja toxicidad y gran resistencia eléctrica. Utilizado en la fabricación de láseres de temperatura ambiente, en la obtención de aleaciones especiales y para colorear materiales cerámicos.
El lutecio se utiliza en la tecnología nuclear. El terbio se emplea para la activación de fósforos, en rayos láser y como contaminante de dispositivos semiconductores.
Los Lantánidos son:
| Cerio | Praseodimio | Neodimio | Promecio
| Samario | Europio | Gadolinio | |
| Número Atómico | 58 | 59 | 60 | 61 | 62 | 63 | 64 |
| Electronegatividad (Pauling): | 1.1
| 1.1 | 1.2 | – | 1.2 | – | 1.1 |
| Peso atómico: | 140.12
| 140.9077 | 144.24 | 145 | 150.4 | 151.96 | 157.23 |
| Densidad: | 6.78
| 6.78 | 7.004 | 7.2 | 7.54 | 5.24 | 7.87 |
| Punto de Fusión:
| 640ºC | 930 | 1024 | 1160 | 1072 | 826 | 1312 |
| Punto de Ebullición:
| 3257 | 3020 | 3027 | – | 1900 | 1489 | 3000 |
| Terbio | Disprosio | Holmio | Erbio | Tulio | Iterbio | Lutecio | |
| Número Atómico | 65 | 66 | 67 | 68 | 69 | 70 | 71 |
| Electronegatividad (Pauling): | 1,2 | – | – | 1,2 | 1.2 | 1.1 | – |
| Peso atómico: | 158.9 | 162.5 | 164.93 | 167.26 | 168.93 | 173.04 | 174.97 |
| Densidad: | 8.332 | 8.54 | 8.803 | 9.16 | 9.318 | 7.01 | 9.85 |
| Punto de Fusión: | 1356 | 1407 | 1461 | 1552 | 1550 | 824 | 1625 |
| Punto de Ebullición:
| 2800 | 2330 | 2600 | 2500 | 1727 | 1427 | 3327 |
Deja una respuesta